病毒滴度(virus titer)表示单位体积 (通常为mL)液体中具有生物活性的病毒颗粒数,是一个用来综合评估病毒毒性和感染力的指标。
空斑实验(Plaque Assay)和TCID50法(50%终点稀释法)是典型的病毒滴度测定方法,通过感染敏感的细胞培养物来测定病毒感染单元或形成病毒斑点数量,从而计算病毒滴度。但存在操作复杂、耗时和结果主观性强等缺点。
基于核酸的定量检测方法(如qPCR法),具有操作简单、灵敏度高,实验周期短和结果更加客观等优点,广泛应用于检测病毒滴度。但检测的是病毒核酸,不能区分病毒的死活,无法真实准确的体现病毒毒性和感染力。
空斑实验(Plaque Assay)
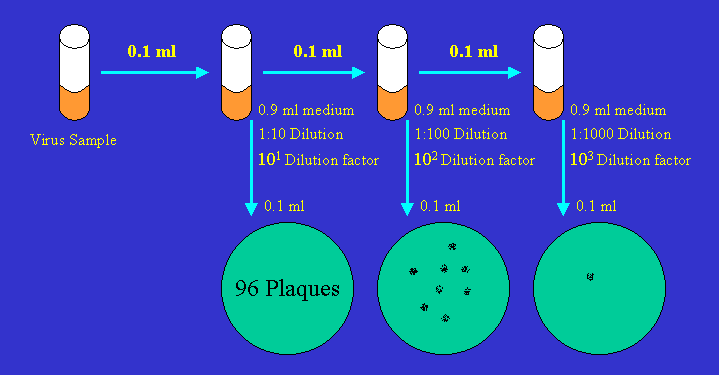
通过将病毒液连续稀释10倍,形成多个梯度的病毒感染剂量,来感染相应的单层敏感细胞。孵育一段时间后,在细胞单层上覆盖一层琼脂糖半固体培养基。继续培养一段时间,病毒感染的细胞死亡后会形成由未感染细胞围绕的小圆斑,即为空斑。当空斑长到足够大时,经过结晶紫染色后,统计不同病毒稀释度下的空斑形成数量,计算每毫升空斑形成单位(pfu/mL)。
具体实验流程:
细胞接种:接种合适数量细胞到6孔板,摇晃培养板使细胞分布均匀,细胞培养箱培养过夜。第二天,细胞达到80%以上的汇合度。
准备病毒梯度稀释液:使用细胞生长培养基,稀释病毒到不同稀释度(一般10-4到 10-8,5个梯度;可以根据实际,进行调整增加)。
感染细胞单层:吸去6孔板中的培养液,每孔加入1ml步骤2中稀释好的不同梯度病毒液,空白对照加1ml细胞生长培养基。每个梯度设计3个复孔。
制备2%低熔点琼脂糖:高压灭菌2%的琼脂糖(无菌水配制),置于42°C水浴中保持熔解状态。细胞培养基预热至37°C。
覆盖琼脂糖:病毒感染1h后,小心吸去病毒液。将2%的琼脂糖和预热的培养基按1:1的比例混匀,加1.5mL混合液轻轻加到每孔细胞上,室温静置20min使其冷却凝固成覆盖层。
6孔板放置在细胞培养箱中,培养 6-10天,肉眼观察空斑形成情况。
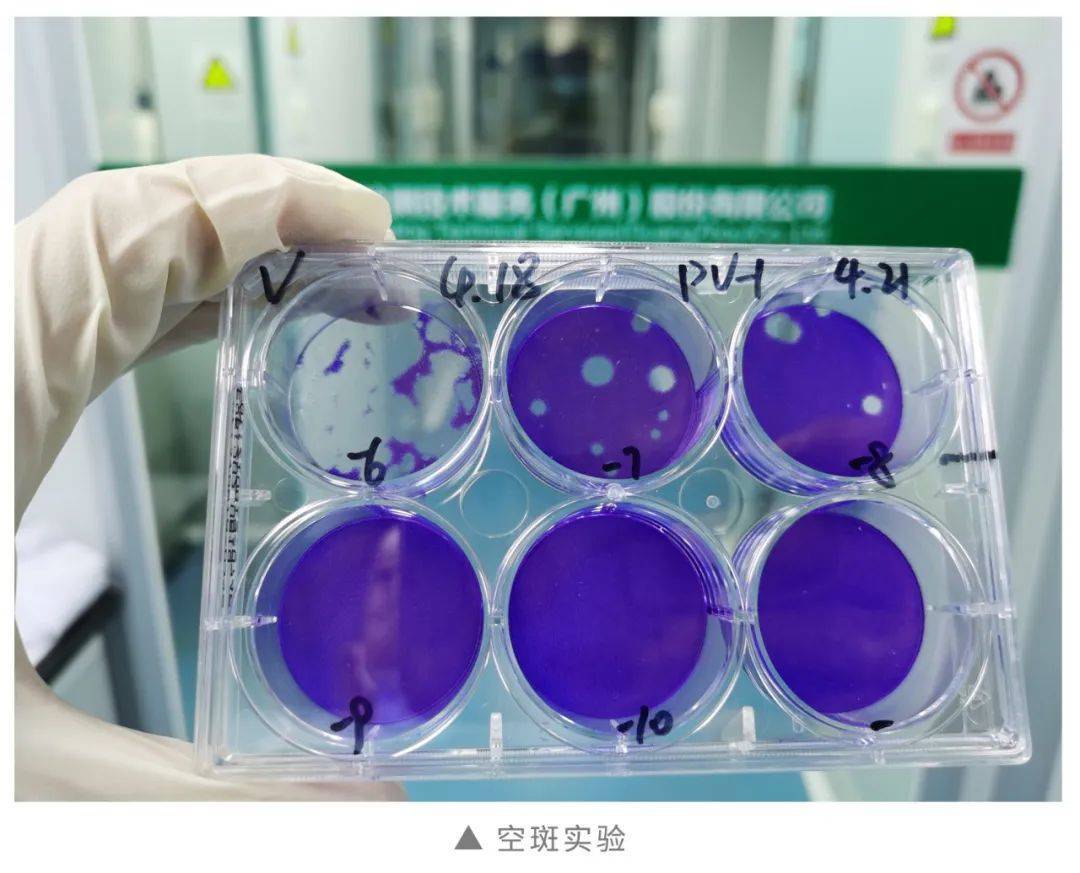
空斑观察和计数:0.1% 结晶紫室温染色30min,未被病毒感染的细胞会被结晶紫染上,而中间未被着色的小区域形成空斑。
统计每个孔的空斑数量,计算病毒滴度:病毒滴度(pfu/ml)=空斑数/稀释倍数
TCID50法测定病毒滴度
TCID50(50% tissue culture infective dose)表示半数细胞培养物感染量,利用不同稀释度的病毒液接种细胞后,能使培养细胞一半发生细胞病变或死亡(cytopathic effect, CPE)所需的病毒量,进而来表征病毒的滴度。
- 培养细胞,接种到96孔细胞培养板,每组8个复孔,放置到细胞培养箱中。5% CO2, 37℃培养,直至长成良好的单层细胞。
- 使用细胞培养基,连续10倍的稀释病毒液,一般10-1到10-10,10个梯度。
- 吸去培养基,将稀释好的病毒加入到96孔细胞培养板中,每一稀释度8个复孔,每孔接种100µl。正常细胞对照组,加100µl细胞培养基。37℃ 5% CO2 培养箱中培养。
- 逐日观察并记录结果,一般需要观察5-7天。
- 观察记录细胞病变 ,包括细胞的肿胀或皱缩、变圆、裂解、脱落,形成蚀斑、聚团、合胞体或内涵体等。
- 根据Reed-Muench法计算TCID50,最后换算成滴度(pfu/mL)
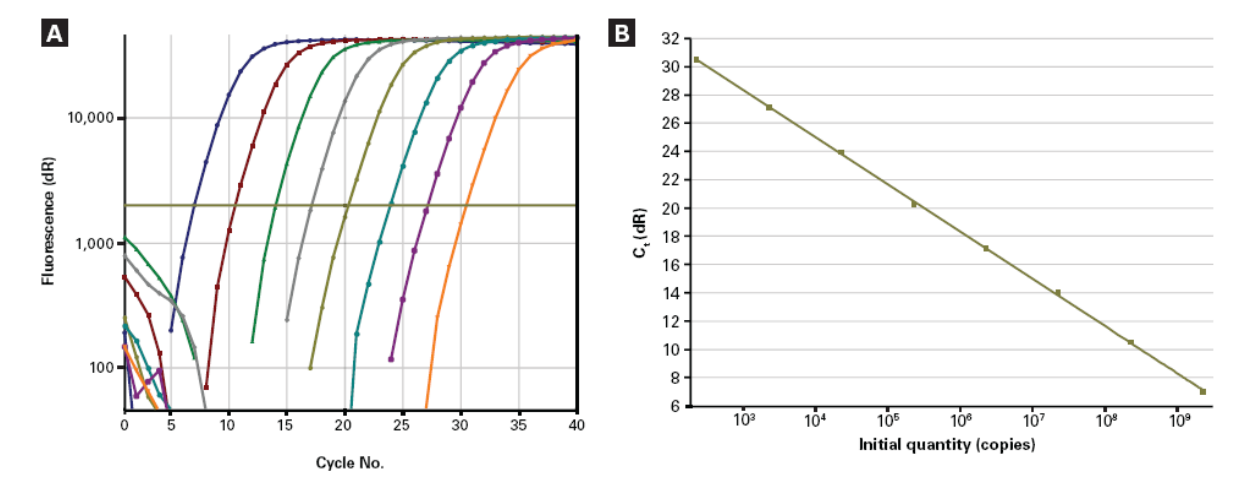
qPCR测定病毒滴度
实时荧光定量PCR(Real-time Quantitative PCR,qPCR),是一种以荧光化学物质检测测每次聚合酶链式反应(PCR)循环后产物总量的方法。qPCR分析也可以用于病毒RNA的鉴定,只需先进行RNA逆转录,然后再进行qPCR定量检测分析。
具体实验流程:
标准品的装备:含有检测目的基因片段的质粒(DNA病毒检测用)或RNA标准品(RNA病毒检测用)。
根据目的基因序列,设计合成引物。
标准品,进行梯度稀释;待测病毒样本,进行合适稀释。
进行qPCR后续检测(RNA病毒,要先进行RNA逆转录)。
根据标准曲线,计算病毒滴度。